国家市场监督管理总局监管所有在中国市场上销售的医疗器械产品。进口医疗器械企业必须要向NMPA进行医疗器械产品注册,同时,还要在中国设立办事处或指定一名在中国的代理人,并且确保提交的所有资料符合中国NMPA的法规要求。
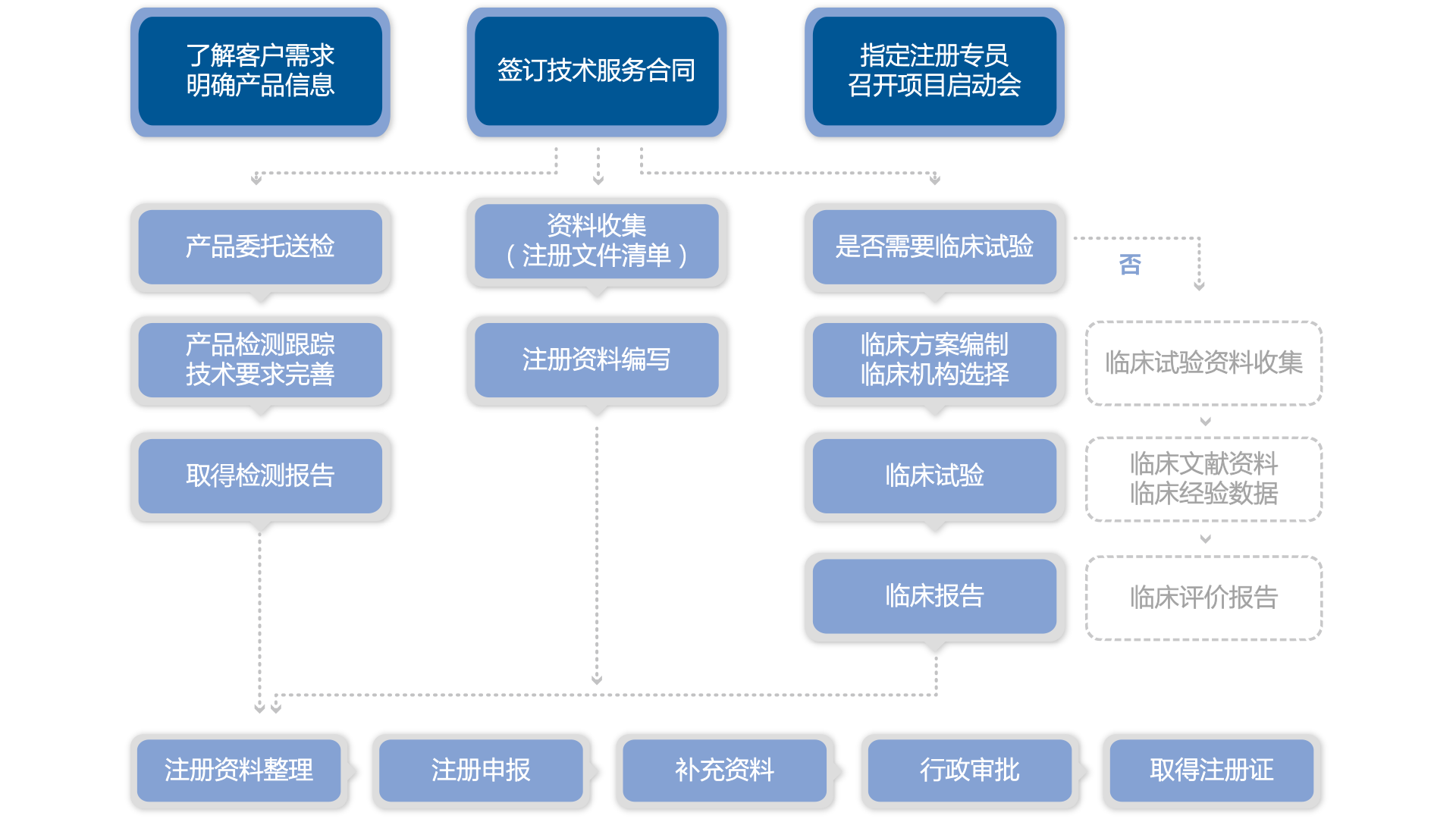
注册申报服务是迈迪思创创立之初始终开展的核心服务之一,服务的产品类型包括I/II/III类有源、无源以及植入医疗器械与体外诊断试剂产品,服务项目涵盖:首次注册、延续注册、登记事项变更、许可事项变更、备案及备案变更、检测代理等。与医疗器械技术审评中心、北京、天津、沈阳、济南、武汉、上海、杭州、广州等医疗器械检验中心/检验所建立了长期良好的沟通关系。目前,我们的注册检测团队由近20位高素质的专业人才组成,注册专员平均从业年限在2.5年以上,每位人员负责的动态项目不超过15个,科学化的项目管理确保项目高效运转。
服务内容:
-
分类界定申请
-
创新产品申请
-
注册方案设计
-
技术要求编写
-
产品检测代理
-
研究资料编写
-
格式文件整理
-
技术审评沟通